REGANGAN RUANG DALAM MOLEKUL SENYAWA ORGANIK. ↶_↷
Setelah
tulisan saya sebelumnya mengenai Konsep Pendahuluan Mengenal Struktur Molekul
Organik, blog saya kali ini akan membahas mengenai regangan ruang yang terjadi
pada sturktur molekul organik. Semoga ulasan ini masih menarik perhatian para
pemburu ilmu. Here we go...!!!
Senyawa
hidrokarbon adalah senyawa organik yang molekulnya tersusun dari atom-atom
karbon dan hidrogen. Terdapat 3 golongan senyawa yang termasuk hidrokarbon yaitu, hidrokarbon alifatik (alkana, alkena, alkuna), hidokarbon alisiklik (siklo
alkana, siklo alkena), dan hidrokarbon aromatik (benzena dan turunannya). Dalam
hidrokarbon alifatik terdapat dua macam golongan yaitu hidrokarbon alifatik jenuh dan hidrokarbon alifatik tidak jenuh.Pada
molekul senyawa organik dapat terjadi fenomena regangan cincin pada reaksi
kimianya.
Regangan ruang muncul pada tahun 1885 seorang ahli kimia
jerman, Adolf Von Baeyer mangemukakan senyawa-senyawa siklik membentuk
cincin-cincin datar. Menurut Baeyer semua senyawa siklik (kecuali siklopetana)
mengalami regangan karena terjadinya penyimpangan dari sudut ikatan tetrahedal.
Makin besar penyimpangan dari sudut iaktan tetrahedal makin besar ragangannya,
yang berakibat makin reaktif pula (MutiaraKhela,2013).
Regangan ruang adalah besarnya regangan pada
struktur senyawa kimia berbentuk siklik untuk menunjukkan seberapa besarnya
regangan ruang dari cicin siklik tersebut. Pada senyawa yang memiliki gugus
asiklik mungkin dapat mengalami regangan ruang apabila terjadinya vibrasi. “teori regangan Baeyer” (Baeyer’s strain
theory).
Menurut teori ini, senyawa siklik seperti halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,5⁰) maka molekulnya mengalami Regangan.
Menurut teori ini, senyawa siklik seperti halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan dalam senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,5⁰) maka molekulnya mengalami Regangan.
Besarnya harga
regangan pada siklopropana tersebut disebabkan oleh adanya regangan sudut dan
regangan sterik. Makin besar penyimpangannya dari sudut tetrahedral, makin
besar pula regangan sudutnya.
Bentuk
molekul merupakan konsep dasar dalam kimia organic.molekul memiliki tiga
dimensi dan interaksi ruang (spatial),dari bagian molekul dengan bagian
lainnya,sangat penting dalam menentukan sifat fisik dan kiminya.
Ada beberapa rancangan model molekul, dengan bahan yang bermacam-macam pula.dua
macam yang terkenal di antaranya adalah model bola,tongkat dan model pengisi
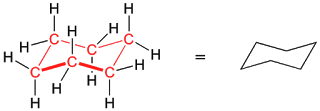
ruang. Model bola dan tongkat menunujukan besarnya sudut ikatan. Konformasi tidak hanya berlaku pada strruktur alifatik tetapi juga pada
struktur siklik. Yang menarik dari konformasi struktur siklik dapat di pelajari
dari model molekul sikloheksana. Dua konformasi ekstrem yang dapat dibuat
adalah konfromasi kursi dan konformasi perahu
Teori atom karbon tetrahedral dan struktur benzene memberikan fondasi teori
struktur senyawa organik. Namun, van’t Hoff dan kimiawan lain mengenali bahwa
masih ada masalah yang tersisa dan tidak dapat dijelaskan dengan teori karbon
tetrahedral. Masalah itu adalah keisomeran yang disebabkan oleh adanya rotasi
di sekitar ikatan tunggal.
Sebagai contoh reaksi dengan bromin, siklopropana menghasilkan
1,3-dibromopropana. Reaksi ini masih bisa terjadi dengan adanya sinar biasa –
tetapi reaksi substitusi juga terjadi pada kondisi ini. Struktur cincin
terputus karena siklopropana mengalami regangan cincin. Sudut-sudut ikatan
dalam cincin menjadi 60° dan tidak normal lagi yaitu sekitar 109.5° ketika
karbon membentuk empat ikatan tunggal. Timpang tindih antara orbital-orbial
atom dalam pembetukan ikatan C-C tidak lagi seperti pada keadaan normal, dan
terjadi tolak-menolak yang cukup besar antara pasangan-pasangan elektron
ikatan. Sistem akan menjadi lebih stabil jika cincin terputus.
Senyawa karbon dengan cincin 3-4 jarang ditemukan dialam karena fenomena
distorsi yang terjadi tolak menolak pasangan elektron yang mengakibatkan
struktur berubah menjadi tidak siklik sehingga di alam jarang ditemukan senyawa
dengan cincin 3-4 dengan bentuk struktur siklik. Hal tersebut dapat dijabarkan
dalam penjelasan berikut ini, perhatikan dengan seksama yaa!!
Pada faktanya, senyawa siklik 5-6 dapat mengalami
perubahan konformasi yang diakibatkan sudut ikatan yang mendekati tetrahedral
sehingga mengakibatkan efek regangan cincin. Gambar struktur siklik yang datar,
sebenarnya tidak dapat mewakili struktur tersebut secara keseluruhan. Contoh :
jika sikloheksan memang datar, maka sudut ikatan harus terdistorsi dari sudut
109,5° ke 120°. Jika kita menggambarkan sebuah model dari sikloheksan dengan sudut
ikatan antar karbon sama dengan tetrahedral, maka akan terbentuk model kursi
lipat (mirip kursi pantai sih). Model inilah ynag dapat mewakili bentuk
sikloheksan.
Selain model konformasi kursi, ada lagi konformasi
dari molekul yang memiliki jumlah Carbon sebanyak 6 buah yaituuuu
Dalam suatu molekul
rantai terbuka, atom-atomnya memiliki peluang tak terhingga jumlah
penataan/posisinya di dalam suatu ruang untuk mencapai kestabilan dengan
menyamai sudut ikatan tetrahedral. Gugus-gugus fungsi yang terikat pada ikatan
karbon-karbon dalam senyawa alkana dapat berotasi dengan bebas mengelilingi
ikatan tersebut. Oleh karena itu atom-atom dalam suatu senyawa rantai terbuka
dapat memiliki posisi yang tak terhingga banyaknya di dalam ruang relatif satu
terhadap yang lain.
Gambar 3-kloro
1-propanol dengan proyeksi Newman.
Konformasi adalah bentuk molekul dan bagaimana bentuk ini
dapat berubah. Dalam senyawa rantai terbuka, gugus-gugus yang terikat oleh
ikatan sigma dapat berotasi mengelilingi ikatan itu. Oleh karena itu atom-atom
dalam suatu molekul rantai terbuka dapat memiliki tak terhingga banyak posisi
di dalam ruang relatif satu terhadap yang lain. Memang etana merupakan sebuah
molekul kecil, tetapi etana dapat memiliki penataan dalam ruang secara
berlain-lain.
Demikianlah yang dapat saya bagikan melalui postingan ini, semoga bermanfaat😃😃
Daftar Pustaka
Anonim.2016. Konformasi Sikloalkana
(online). https://ulthawindaraekawardanni.wordpress.com/.
Diakses 11 November 2016.
Anonim. 2012.
Sikloalkana (online). http://mychemicaldream.blogspot.co.id/2012/09/sikloalkana.html.
Diakses 12 November 2016.
Fessenden, J.S.
Fessenden. 1986. Kimia Organik. Jakarta: Erlangga.
Hart. 2003. Kimia Organik Suatau Kuliah Singkat. Jakarta: Erlangga.




wahh trimakasih ya kak, ulasannya bermanfaat dan dapat saya pahami..
BalasHapusTerimakasih untuk informasinya, yang ingin saya tanyakan antara molekul siklik dan asiklik yang mana yang akan lebih memiliki usaha lebih besar untuk mecapai kestabilan regangannya??
BalasHapustrimksh utk kunjungannya, nahhhh kestabilan regangannya ada pada siklik sist..
Hapusterimakasih materinya, sangat membantu dan banyak memberikan informasi yang bermanfaat..
BalasHapusOo jadi begitu.. semakin mengerti,terimakasih banyak untuk artikelnya ya.. semangat blogging, kunjungi juga :v hutingku.blogspot.co.id
BalasHapusterima kasih, ilmunya sangat bermanfaat. hanya saja pengaruh dari regangan itu sendiri dengan bentuk molekul dan kestabilannya bagaimana?
BalasHapusterimakasih infonya sangat bermanfaat, saya ingin bertanya apa yang menyebabkan terjadinya regangan ruang dalam suatu senyawa
BalasHapusThanks ... Sangat mambantu 😊
BalasHapusterimaksih, saya tertarik dengan ulasan yang anda jabarkan tidak terlalu berbeletit semoga bermanfaat untuk teman-teman yang lain
BalasHapusNice info.. Sangat bermanfaat.. Semoga kedepan bisa lebih baik lagi
BalasHapusTerima kasih informasinya kak.. Sangat bermanfaat dan semoga ada informasi yg sangat bermanfaat
BalasHapusTerimakasih materinya..sungguh bermanfaat..alangkah baiknya, jika di tambahkan materi konformasi regangan ruang dari senyawa asiklik ya..trmksh
BalasHapusTerimakasih atas penjelasannya, sangat bermanfaat :)
BalasHapusTerima kasih atas pemaparannya,saya mau tanya selain konformasi kursi,tlong sebutkan konformasi lainnya?
BalasHapusterima kasih atas materi yang sudah Anda jelaskan di atas. Sangat bermanfaat dalam referensi pembelajaran:)
BalasHapus